NMN(ニコチンアミド モノヌクレオチド)と筋萎縮性側索硬化症(ALS)との関係
昨日、わたしたちのクリニックでNMN(ニコチナミド モノヌクレオチド)点滴治療を受けている方から電話がありました。
「NMN点滴治療により筋萎縮性側索硬化症(ALS)になる危険性があると聞きました。」
その際、わたしの知識として「ある酵素を欠損しており、既に神経障害をもっている患者さまで起こることと理解しております。その徴候がみられていませんので大丈夫ですよ」と答えました。
そこで、きちんと最新の情報を整理してみました。
まず、筋萎縮性側索硬化症(ALS)は、運動神経細胞が選択的に変性し、進行性の麻痺と筋萎縮を呈する神経難病です。大脳皮質運動野の上位運動ニューロンおよび脳幹と脊髄の下位運動ニューロンの変性によって、典型的な例では上肢または下肢の筋力低下から症状を自覚し、頚部、顔面、嚥下筋へと麻痺症状が進行していきます。最近、ミトコンドリア自身のみならず、小胞体との接触部位が破たんすることによって、ALSにおけるミトコンドリア異常が生じることが明らかとなってきました。
NMNAT2欠損
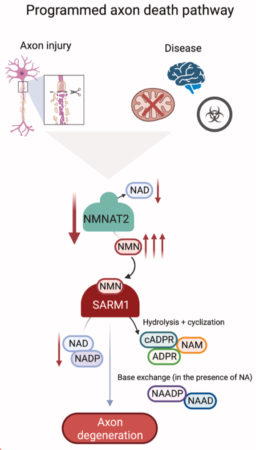
軸索変性は、多くの神経変性疾患の中心的な病理学的特徴です。ニコチンアミドアデニン ジヌクレオチド(NAD+)代謝は、老化、概日リズム、軸索の生存などのさまざまな生物学的プロセスを制御します。軸索は、その維持をNAD+生合成の中心酵素であるニコチンアミド モノヌクレオチド アデニリルトランスフェラーゼ 2 (NMNAT2) の活性に依存しており、この活性が失われると急速に変性します。NAD+のヌクレオチド前駆体であるニコチンアミドモノヌクレオチド(NMN)が神経損傷後に蓄積し、軸索変性を促進することが示されました。SARM1は、NAD+切断酵素であり、その活性化により軸索破壊が引き起こされます。NMNをNAD+に変換する生合成酵素NMNAT2が失われると、SARM1が活性化されます。
SARM1の活性化はNAD+の酵素的破壊とその後の軸索変性を誘導します。SARM1の活性化は、末梢神経障害、外傷性脳損傷、緑内障、網膜変性などの多くの神経変性疾患を促進します。SARM1は、軸索における役割が確立されているだけでなく、特定の条件下で神経細胞死を促進する可能性があります。
NAD+は、神経障害、糖尿病、老化、酸化ストレス、神経変性疾患などのいくつかの生理学的状態において重要な役割を果たしています。NMNは、NAD+の前駆体として作用することでNAD+レベルを上昇させます。
しかし、NMNのレベルを高める複数の操作は軸索変性を引き起こさず、代わりに損傷後に軸索を強力に保護します。NMNの低レベルと高レベルの両方が強力な軸索保護と一致するため、NMNの変性促進活性の仮定には依然として議論の余地があり、追加の要因に依存する必要があります。
ミトコンドリア欠損
ミトコンドリアの欠損は、メタボロミクスとエネルギー恒常性の調節不全を引き起こし、主に筋萎縮性側索硬化症(ALS)の家族性症例と散発性症例の両方に存在し上部運動ニューロンで検出されます。種に関係なく、広範囲のALS患者の上部運動ニューロンと、マウスモデルの皮質脊髄運動ニューロン(別名マウスの上部運動ニューロン)は、どちらも細胞型特異的な様式で顕著なミトコンドリア欠損を示します。
酸化ストレスはALSの顕著な生理学的特徴であり、酸化ストレスを軽減するメカニズムが損なわれています。 ALS患者の運動皮質では、健康な対照と比較してグルタチオン (GSH) レベルが低下していることが報告されています。同様に、ALSのマウスモデルでは、GSHの枯渇により、脊髄運動ニューロンの変性、ミトコンドリアの機能不全、およびニューロンの喪失が起こりました。GSHは、ミトコンドリアによって生成される活性酸素種 (ROS)を除去するために非常に重要であり、過酸化水素と過酸化脂質を解毒する抗酸化酵素の基質でもあります。重要なことに、初期の研究で既にGSH欠乏症とミトコンドリア損傷との相関関係が実証されています。
NAD+/NADH比の乱れはエネルギー不足を示し、ALSを含む多くの病気に関連しています。NAD+はさまざまな基質から放出されたH+を受け入れてNADHに変換し、ATPを放出します。ATPの継続的な生成には、バランスの取れたNAD+/NADH比が重要です。代謝調節異常はNAD+の枯渇をもたらし、それがエネルギー恒常性に影響を与えます。NAD+レベルは、NR (ニコチンアミドリボシド)、NAM (ニコチンアミド)、NA (ナイアシン)、NMN (ニコチンアミド モノヌクレオチド) などの化合物によって回復できます。これらの前駆体は、エネルギー生成経路ですぐに使用できるNAD+に変換されます。NAD+レベルの回復は、アルツハイマー病や脳内出血に対して有益であり、神経保護効果がありました。 さらに、NAD+の増強により、in vitroで星状細胞媒介神経毒性が軽減されることが示されています。ALSのマウスモデルをNRで治療すると、脊髄運動ニューロンの変性が遅くなり、神経炎症が軽減されたという報告もあります。
このようにミトコンドリアを介した代謝障害がALSの一般的な特徴として浮上しており、NAD+前駆体化合物によるNAD+レベルの回復が実際にニューロンの健康を改善するための潜在的な治療戦略となる可能性があります。
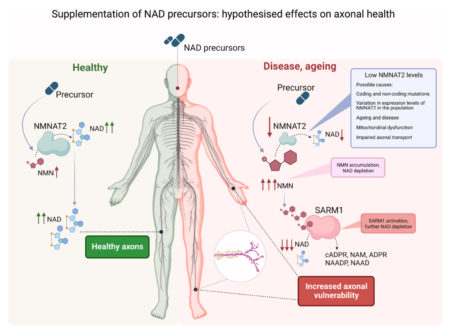
NMNへの長期曝露は、SARM1と相互作用し、その活性を調節することにより、NAD+を維持するため、軸索の安定性やニューロンの健康にとって好ましくない可能性がありますが、病状によって病気になっている人の健康に重要な寄与をしているようです。したがって、罹患した運動野の初期に起こる代謝学的問題を理解することの独特の重要性を示唆しており、脳内の混乱したNAD+レベルを再確立することによる新しい治療戦略の開発が待たれます。

