ヘムとポルフィリン 2:ヘモグロビンと酸素の結合
赤血球が赤く見えるのは、細胞質中にヘモグロビン(血色素)を含んでいるからです。
ヘモグロビンは酸素(O2)と結合すると鮮赤色、酸素と結合していないと暗赤色となるため
動脈血は鮮赤色
静脈血は暗赤色
に見えます。
ちなみに一酸化炭素(CO)はヘモグロビンに対して酸素よりも250倍親和性が高く
死後皮膚紅潮が見られるのは、このカルボキシヘモグロビン(COHb)の色に起因します。
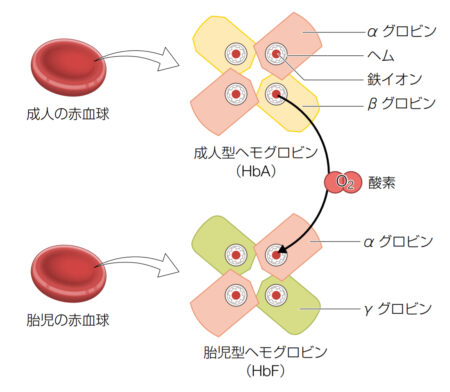
ヘモグロビン(Hb)分子は
1つのヘムと1つのグロビン鎖からなるサプユニットが4つ結合してできた四量体です。
ヘムはプロトポルフィリンの中心に鉄(Fe2+)が結合したものです。
この鉄に1分子の酸素が結合します。
したがって、ヘモグロビン1分子は最大で4分子の酸素を運ぶことができます。
サブユニットに1個ずつあるヘム鉄(Fe2+)はヘモグロビンの酸素供給機能に深く関わっており、
肺で酸素を受けとり、身体の各部に酸素を届けます。
面白いことに、1つのサブユニットのへム鉄に酸素が結合すると、
別のサブユニットのヘム鉄に酸素が結合しやすくなるようです。
分子レベルで遠く離れたヘム鉄同士のこのような連鎖反応は「アロステリック効果」と呼ばれており、
ヘム鉄の電子状態の変化が蛋白質の構造変化をもたらし、
その構造変化はジッパーが開くように迅速に他のサブユニットに波及すると考えられています。
さらに上の図で示したように、胎児のヘモグロビンは成人のヘモグロビンよりも酸素に結合しやすいので、
胎盤内で、母親の血液が運ぶ酸素が容易に胎児の血液へと移行します。

